Würzburg. Das Immunsystem eines Neugeborenen unterscheidet sich deutlich von dem eines Erwachsenen. Während Erwachsene über ein ausgereiftes, hoch spezialisiertes Immunsystem verfügen, ist das Immunsystem von Neugeborenen vor allem auf die angeborene Immunabwehr angewiesen, die noch nicht die Fähigkeit hat, starke Entzündungsreaktionen einzuleiten. Ob dies ein Nachteil ist oder eine sinnvolle Schutzmaßnahme und beispielsweise das Risiko einer Neugeborenen-Sepsis senkt, ist bislang ungeklärt. Die Sepsis ist weltweit immer noch eine der häufigsten Todesursachen bei Neugeborenen.
Einen wichtigen Beitrag, um das Sepsisrisiko besser zu verstehen und möglicherweise neue Schutzmaßnahmen für Neugeborene zu entwickeln, hat jetzt Prof. Dr. Dorothee Viemann, Leiterin der Translationalen Pädiatrie am Universitätsklinikum Würzburg (UKW), gemeinsam mit Forschenden der Universitätsmedizin Würzburg, Hannover, Bonn, Braunschweig und Lübeck veröffentlicht. Ihre Studie charakterisiert erstmals die immunmetabolischen Anpassungsprozesse von Blutmonozyten bei gesunden Neugeborenen, Säuglingen und Kindern. Blutmonozyten sind Teil des angeborenen Immunsystems und bilden damit die erste Verteidigungslinie gegen Infektionen.
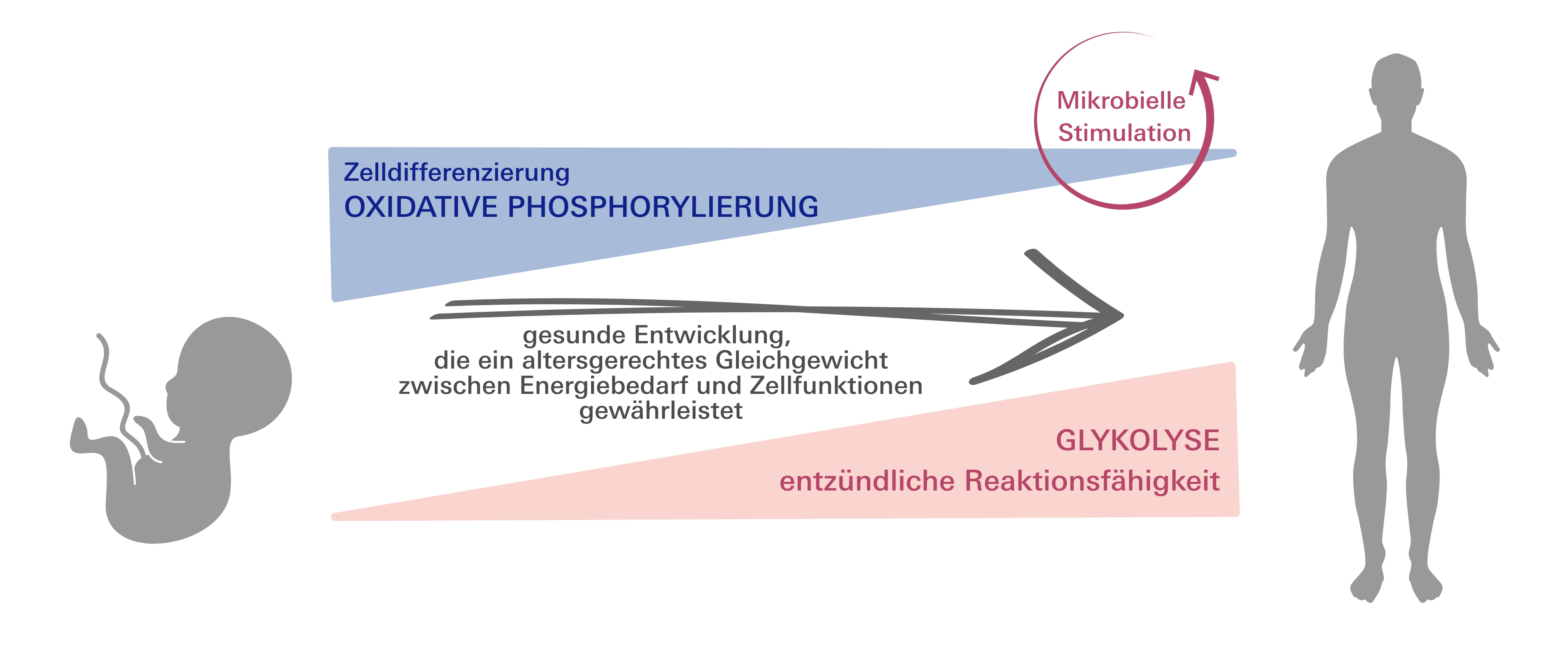
Stoffwechsel von Immunzellen verändert sich mit dem Alter - von der oxidativen Phosphorylierung zur Glykolyse
In der Studie, die in der renommierten Fachzeitschrift Nature Communications publiziert wurde, zeigte das Team, dass sich die Stoffwechselaktivität von neugeborenen und erwachsenen angeborenen Immunzellen stark unterscheidet. Die Wissenschaftlerinnen und Wissenschaftler fanden heraus, dass die Blutmonozyten von Neugeborenen mehr Energie produzieren als die von Erwachsenen. Blutmonozyten machen bis zu acht Prozent der weißen Blutzellen (Leukozyten) aus und zirkulieren ein bis drei Tage im Blut, bevor sie ins Gewebe einwandern und sich dort weiterentwickeln.
Um ihre Immunzellen reifen zu lassen nutzen Neugeborene verstärkt die oxidative Phosphorylierung. Dabei wird in den Mitochondrien, den "Kraftwerken" der Zellen, aus Nährstoffen Energie gewonnen und das Molekül ATP (Adenosintriphosphat) produziert, das die Zellen für alle wichtigen Funktionen benötigen. Mit zunehmendem Alter wechselt dieser Stoffwechsel allmählich auf die Glykolyse um, eine andere Art der Energiegewinnung, die stärkere Entzündungsreaktionen ermöglicht.
Stoffwechsel wird durch Umwelt beeinflusst und kann durch ketogene Ernährung nicht zurückgesetzt werden
Die Forschenden entdeckten, dass erst durch den Kontakt mit der Umwelt, insbesondere mit Mikroben wie Bakterien und Viren, das Immunsystem von Neugeborenen trainiert wird. Die Umweltexposition führt dazu, dass sich der Stoffwechsel neonataler Monozyten allmählich verändert und sich dem von Erwachsenen annähert. Interessanterweise konnte eine ketogene Diät, also eine fettreiche, kohlenhydratarme Ernährung, die den natürlichen Stoffwechselzustand von Neugeborenen nachahmt, den ursprünglichen Stoffwechsel dieser Immunzellen nicht wiederherstellen. Das bedeutet, dass der Stoffwechsel von Monozyten durch die Umwelt beeinflusst wird und nicht einfach durch eine spezielle Ernährung zurückgesetzt werden kann.
Verminderte glykolytische Aktivität ist nicht für Infektanfälligkeit verantwortlich
Mit ihrer Arbeit lösen die Forschenden ein altes Paradigma ab. Denn bisher wurde postuliert, dass die reduzierte Fähigkeit von Neugeborenen, durch Glykolyse Energie zu gewinnen, die Ursache für verminderte Entzündungsreaktionen und damit verantwortlich für die Infektanfälligkeit von Neugeborenen sei. Die umfassend charakterisierten und identifizierten immunmetabolischen Eigenschaften des angeborenen Immunsystems deuten dagegen darauf hin, dass eine vorzeitige Aktivierung der Glykolyse bei Neugeborenen das Risiko für schwere Sepsisverläufe erhöhen würde, da es inflammatorische Reaktionen schürt aber nicht die notwendige Energie für weitere erforderliche Zelldifferenzierungsvorgänge liefert. Viemann appelliert: „Die Behandlung von Neugeborenen im Sinne einer Förderung glykolytischer Stoffwechselprozesse sollte vermieden werden, um überschießende Entzündungsreaktionen zu verhindern und immunologische Reifungsprozesse nicht zu stören.“
Der nächste Schritt wäre, die Analysemethoden in Geburtskohortenstudien zu integrieren. Auf diese Weise könnte es gelingen, klinische und demographische Faktoren zu ermitteln, die die Stoffwechselaktivität von Neugeborenen signifikant beeinflussen. Spannend wäre es auch, so Viemann, die Untersuchungen auf andere Zelltypen des Immunsystems auszudehnen.
Unterstützung durch Eltern, Technologien und Fördermittel
„Die umfassende Identifizierung und Charakterisierung immunmetabolischer Eigenschaften des angeborenen Immunsystems war durch die Anwendung neuester Technologien möglich, vor allem aber durch die Bereitschaft der Eltern gesunder Neugeborener, Säuglinge und Kleinkinder, an der Studie teilzunehmen“, sagt Dorothee Viemann.
Ferner wurde die Arbeit maßgeblich durch Stipendien des Bundesministeriums für Bildung und Forschung (BMBF) und der Deutschen Forschungsgemeinschaft (DFG) unterstützt sowie im Rahmen des SFB 1583/1 (DECIDE), TRR 359 (PILOT) und der Exzellenzstrategie der DFG Deutschland - EXC 2155 (RESIST) gefördert.
Publikation:
Greta Ehlers, Annika Marie Tödtmann, Lisa Holsten, Maike Willers, Julia Heckmann, Jennifer Schöning, Maximilian Richter, Anna Sophie Heinemann, Sabine Pirr, Alexander Heinz, Christian Dopfer, Kristian Händler, Matthias Becker, Johanna Büchel, Achim Wöckel, Constantin von Kaisenberg, Gesine Hansen, Karsten Hiller, Joachim L. Schultze, Christoph Härtel, Wolfgang Kastenmüller, Martin Vaeth, Thomas Ulas & Dorothee Viemann. Oxidative phosphorylation is a key feature of neonatal monocyte immunometabolism promoting myeloid differentiation after birth. Nat Commun 16, 2239 (2025). https://doi.org/10.1038/s41467-025-57357-w
Text: KL / Wissenschaftskommunikation